كم عدد نيوترونات عنصر النيون؟
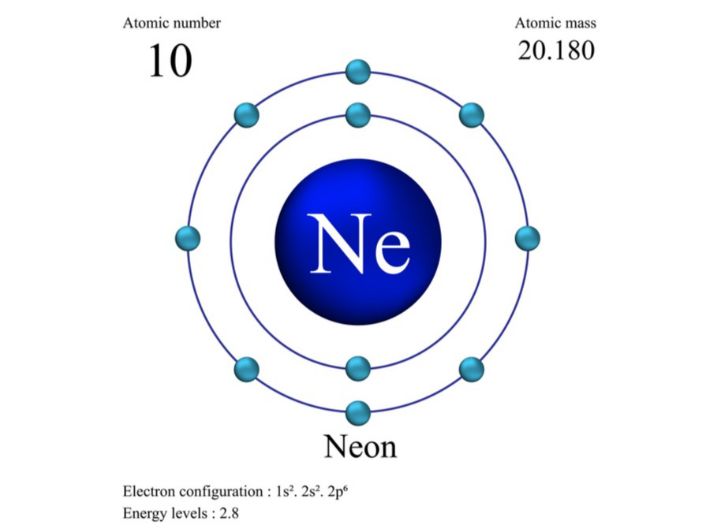
تعتمد معرفة عدد نيوترونات العنصر على فهم طبيعة كلًا من العدد الذري والعدد الكتلي للعنصر، وذلك لأن عدد النيوترونات يمكن معرفته من خلال العدد الكتلي الذي يعتمد على العدد الذري، فالعدد الذري للعنصر (بالإنجليزية: Atomic number) هو عدد البروتونات في نواة ذرة العنصر، أما العدد الكتلي (بالإنجليزية: Mass number) فهو مجموع عدد البروتونات والنيوترونات في نواة ذرة العنصر، وهو يختلف باختلاف نظائر العنصر، فالنظائر هي ذرات لنفس العنصر تتطابق في العدد الذري، لكنها تختلف في العدد الكتلي، أي أنها جزيئات لها نفس عدد البروتونات، لكنها تختلف في عدد النيوترونات.[١]
بناءً على هذا، فإن العدد الذري لعنصر النيون يساوي 10، أي أن له 10 بروتونات، أما عدد النيوترونات الموجودة في ذرات عنصر النيون، فيختلف باختلاف نظائره، وذلك كالآتي:[١]
- نظير النيون Ne-20: العدد الكتلي لهذا النظير يساوي 20، أي أنه يمتلك 10 بروتونات و 10 نيوترونات.
- نظير النيون Ne-21: العدد الكتلي لهذا النظير يساوي 21، أي أنه يمتلك 10 بروتونات و 11 نيوترونًا.
- نظير النيون Ne-22: العدد الكتلي لهذا النظير يساوي 22، أي أنه يمتلك 10 بروتونات و 12 نيوترونًا.
نظائر عنصر النيون
لعنصر النيون العديد من النظائر، والتي تتراوح ما بين Ne-16 إلى Ne-34، وتختلف هذه النظائر في عدد النيوترونات المتواجدة في أنوية ذرّاتها، ويمكن معرفة عدد النيوترونات لكل نظير من خلال طرح العدد الذري الثابت (عدد البروتونات) من العدد الكتلي للنظير، فعلى سبيل المثال:[٢]
- عدد نيوترونات النظير Ne-16: العدد الكتلي - العدد الذري = 16 - 10 = 6 نيوترونات.
- عدد نيوترونات النظير Ne-34: العدد الكتلي - العدد الذري = 34 - 10 = 24 نيوترونًا.
كما أن هذه النظائر تختلف في نسبة انتشارها الطبيعي وفي مستويات استقرارها، حيث إن نظائر النيون من Ne-16 إلى Ne-19، ومن Ne-23 إلى Ne-34 تعتبر نظائر مشعة، أي غير مستقرة، وتمر هذه النظائر بما يسمى بالاضمحلال النووي لكل تصل للاستقرار، ولا تتواجد بشكل مستقر في الطبيعة، أما الثلاث نظائر المستقرة في الطبيعة فهي:[٢]
- نظير النيون Ne-20: وتبلغ نسبة انتشاره في الطبيعة 90.48% من إجمالي نسبة انتشار نظائر النيون المستقرة.
- نظير النيون Ne-21: وتبلغ نسبة انتشاره في الطبيعة 0.27% من إجمالي نسبة انتشار نظائر النيون المستقرة.
- نظير النيون Ne-22: وتبلغ نسبة انتشاره في الطبيعة 9.25% من إجمالي نسبة انتشار نظائر النيون المستقرة.
أهم خصائص عنصر النيون
للنيون العديد من الخصائص الكيميائية والفيزيائية التي تميزه عن غيره من العناصر، ومن أهمها ما يأتي:[٣]
- الرمز الكيميائي للنيون (Neon): Ne.
- الموقع في الجدول الدوري: ينتمي للمجموعة 18 وللدورة 2.
- الحالة الفيزيائية عند حرارة 20 درجة مئوية: يتواجد في الحالة الغازية.
- درجة الانصهار: يتحول النيون من الحالة الصلبة إلى الحالة السائلة عند حرارة −248.59 درجة مئوية.
- درجة الغليان: يتحول النيون من الحالة السائلة إلى الحالة الغازية عند حرارة −246.046 درجة مئوية.
- الكثافة: يمتاز النيوم بكثافته الضئيلة، والتي تبلغ 0.000825 جرام لكل سنتمتر مكعب.